Ik ga zeggen: nee , dit werkt in de praktijk niet. In feite werkt het zelfs niet eens in theorie.
In een eenvoudige theorie zou je zeggen dat de α C-H-binding de zwakste is omdat de resulterende radicaal wordt gestabiliseerd door conjugatie in de C = O. Maar onder radicale omstandigheden zien we geen α-chlorering in het laboratorium. Is er een betere manier om dit uit te leggen?
De chloorradicaal
Het probleem is tweeledig. Ten eerste is het chloorradicaal $ \ ce {Cl.} $ Veel minder stabiel en daarom uiterst niet-selectief in radicale chloreringen. In de fysische organische chemie citeren we iets dat het Hammond-postulaat wordt genoemd, dat zegt dat in dit geval de overgangstoestand voor waterstofonttrekking meer lijkt op het uitgangsmateriaal dan op het product. Daarom heeft de stabiliteit van het product geen significante invloed op de activeringsenergie en de snelheid van de waterstofonttrekking.
Bovendien is het wat we zouden beschouwen als een "elektrofiel radicaal". ; het heeft een zeer lage energie SOMO, en heeft daarom de neiging om een meer elektronenrijk waterstofatoom te abstraheren. In wezen betekent het dat de radicaal zich meer als een elektrofiel dan als een nucleofiel gedraagt. In de overgangstoestand voor waterstofonttrekking, wil chloor wil een aanzienlijke opeenhoping van negatieve lading op zichzelf hebben (onthoud dat het product van waterstofonttrekking $ \ ce {HCl} $ zal zijn) . Het geldt dus voor de waterstof die het meest bereid is om het deze negatieve lading te geven, en dat is het meest elektronenrijke waterstofatoom.
Een voorbeeld
Overweeg de radicale chlorering van propionzuur, dwz $ \ ce {R} = \ ce {CH3} $ in uw diagram hierboven.
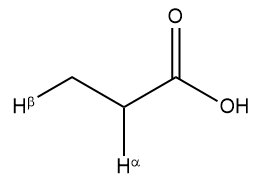
De α-waterstof, vergeleken met de β-waterstof, is relatief elektronenarm vanwege de elektronenonttrekking door de $ \ ce {-COOH} $ -groep. Het blijkt dus dat de onttrekkingssnelheid van de α-waterstof veel langzamer is: $ k_ \ alpha / k_ \ beta = 0,03 $ (Moody & Whitham, Reactive Intermediates , p 12). Hier is een artikel dat de selectiviteit bespreekt die wordt waargenomen bij de chlorering van propionzuur onder verschillende omstandigheden: Tetrahedron , 1970 , 26 , 5929.
Zoals geschreven in Carey & Sundberg 5e editie, deel A, p 1022:
Radicale chlorering vertoont een substantieel polair effect. Posities die zijn gesubstitueerd door EWG [elektronenzuigende groepen] zijn relatief niet-reactief ten aanzien van chlorering, hoewel de substituenten in staat zijn het radicale tussenproduct te stabiliseren. [...] Omdat het chlooratoom zeer reactief is, wordt verwacht dat de reactie een zeer vroege TS [overgangstoestand] heeft en het elektrostatische effect overheerst boven het stabiliserende effect van de substituent op het tussenproduct. Het elektrostatische effect is de dominante factor in de kinetische selectiviteit van de reactie en de relatieve stabiliteit van het radicale tussenproduct heeft relatief weinig invloed.
Als voorbeeld gebruiken ze de chlorering van butyronitril, dat is hetzelfde als propionzuur, behalve dat de EWG nu $ \ ce {-CN} $ is in plaats van $ \ ce {-COOH} $:
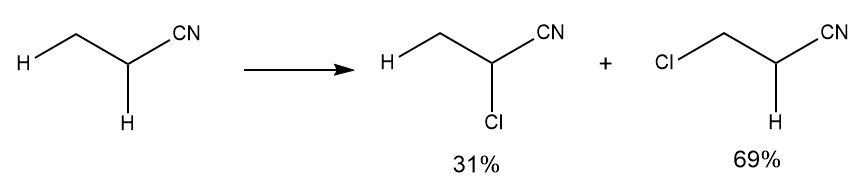
Zoals @Loong in de commentaren vermeldt, is er in het specifieke geval van propionzuur nog een probleem: er zijn drie β-waterstofatomen om te abstraheren, en slechts twee α-waterstofatomen. Daarom, zelfs als al het andere dat ik heb beschreven, ontbreekt, verwachten we dat er 1,5 keer zoveel chlorering op de β-positie is. Dit helpt zeker niet bij de selectiviteit! Het belang van statistische factoren wordt het duidelijkst gezien bij de radicale chlorering van eenvoudige alkanen, waarbij alle waterstofatomen vrijwel gelijk zijn. Ik zal hier niet in detail treden, maar je kunt dit antwoord (opnieuw door Loong) bekijken, en er zijn voorbeelden op Clayden 2e ed., Pp. 987-8.
De oplossing
Als je propionzuur selectief zou willen chloreren op de α-positie, zou je een polair mechanisme gebruiken dat via de enol verloopt. Het bovenstaande artikel bevat enkele voorbeelden van omstandigheden die werken. Ze hebben allemaal betrekking op het onderdrukken van de radicale reactie door radicale aaseters toe te voegen.